
Gestione delle lesioni nervose del cavo orale
Coordinatore:
- Biglioli Federico (Professore Ordinario e Direttore della Scuola di Specializzazione in Chirurgia Maxillo-Facciale, Dipartimento di Scienze della Salute, Università degli Studi di Milano; Direttore dell’UO Complessa di Chirurgia Maxillo-Facciale dell’ASST Santi Paolo e Carlo di Milano).
Gruppo di Lavoro:
- Allevi Fabiana (Ricercatore Universitario, Dipartimento di Scienze della Salute, Università degli Studi di Milano; Specialista in Chirurgia Maxillo-Facciale presso l’UO di Chirurgia Maxillo-Facciale – ASST Santi Paolo e Carlo di Milano );
- Demartini Laura (Specialista in Anestesia e Rianimazione e Terapia del dolore; Responsabile dell’Unità di Terapia del Dolore della Fondazione Salvatore Maugeri di Pavia; Professore a Contratto presso la scuola di Specializzazione di Anestesia, Rianimazione, Terapia Intensiva e del Dolore dell’Università degli Studi di Pavia );
- Ferrieri Giovanni (Specialista in Odontostomatologia; Responsabile del Reparto di Chirurgia Odontostomatologica presso la Clinica Odontoiatrica dell’Istituto Ortopedico Galeazzi; Professore a Contratto presso Università degli Studi di Milano);
- Gennaro Paolo (Professore Associato e Direttore della Scuola di Specializzazione in Chirurgia Maxillo-facciale dell’Università di Siena, Dipartimento di Biotecnologie Mediche; Direttore dell’UOC di Chirurgia Maxillo Facciale dell’Azienda Ospedaliero-Universitaria Senese);
- Lozza Alessandro (Specialista in Neurologia, Libero Professionista svolge attività di Consulente Medico e Scientifico; Professore a contratto presso l’Università degli Studi di Milano, di Sassari, di Pavia e l’Università dell’Insubria );Mariani Vera (Psicologa e Psicoterapeuta presso l’USD di Psicologia
- Clinica dell’ASST Santi Paolo e Carlo di Milano);
- Novelli Giorgio (Specialista in Chirurgia Maxillo-facciale presso l’UO di Chirurgia Maxillo- facciale dell’Azienda Ospedaliera San Gerardo di Monza; Professore a contratto presso la scuola di specializzazione in Chirurgia Maxillo-facciale dell’Università degli Studi di Milano- Bicocca );
- Pispero Alberto (Specialista in Chirurgia Odontostomatologica presso la Clinica Odontoiatrica dell’ASST Santi Paolo e Carlo di Milano. Segretario IAO);
- Sardella Andrea (Professore Ordinario presso il Dipartimento di Scienze Biomediche, Chirurgiche e Odontoiatriche dell’Università degli Studi di Milano; Direttore dell’UO di Odontoiatria e Stomatologia della Clinica Odontoiatrica dell’ASST Santi Paolo e Carlo di Milano);
- Scarpelli Marco (Specialista in Odontostomatologia, Medicina Legale; Prof. a C. in “Fondamenti normativi e di deontologia” presso l’Università degli Studi di Firenze);
- Vegni Elena (Professore Ordinario presso il Dipartimento di Scienze della Salute, dell’Università degli Studi di Milano; Direttore dell’UO di Psicologia Clinica dell’ASST Santi Paolo e Carlo di Milano);
- Zardoni Manuela (Specialista in Neurologia presso l’UO di Neurologia dell’ASST Santi Paolo e Carlo di Milano ).
Introduzione
Le lesioni neurologiche del cavo orale occorrono in corso di Chirurgia Orale e Maxillofacciale in diverse situazioni cliniche: avulsione degli ottavi inferiori, implantologia, terapie endodontiche, anestesie tronculari, traumi, chirurgia tumorale, etc. I rami nervosi prevalentemente coinvolti sono rappresentati dal nervo linguale (NL) e dal nervo alveolare inferiore (NAI). Sono peraltro non trascurabili le lesioni del nervo infraorbitario, zigomatico-facciale, nasopalatino, e rami alveolari e dentari.
La letteratura riporta l’avulsione degli ottavi inferiori come causa principale di lesione iatrogena del NL (0.6-2%) e del NAI (0.4-1.1%). [1-8] Parestesie conseguenti al trattamento endodontico vengono riportate in letteratura con un’incidenza di 0.96%. [9]
Lesioni temporanee o permanenti del nervo alveolare inferiore conseguenti al posizionamento di impianti sono riportate in letteratura in un range compreso tra 0,19% e 2.2% di tutti gli impianti posizionati. [10] Ancora oggi però la problematica è poco conosciuta tra i professionisti, in termini di riconoscimento rapido della lesione e dell’iter diagnostico-terapeutico da adottare.
Cenni anatomici
Nervo linguale
Origina dal tronco posteriore del nervo mandibolare, terza branca del trigemino, e accoglie fibre sensitive somatiche, fibre sensitive specifiche della sensibilità gustativa per i due terzi anteriori della lingua e fibre per l’innervazione parasimpatica delle ghiandole sottomandibolare e sottolinguale. Dalla sua origine, il nervo linguale decorre anteriormente tra i muscoli pterigoidei esterno e interno e successivamente tra il muscolo pterigoideo interno e la faccia mediale del ramo della mandibola dove affiora sulla superficie sottoperiostea all’altezza del trigono retromolare. Il nervo linguale decorre poi nel pavimento orale tra i muscoli ioglosso e genioglosso (situati medialmente) e la ghiandola sottolinguale (situata lateralmente), ricoperto in superficie solo dalla mucosa del pavimento orale. Si dirige in avanti, all’apice della lingua, risolvendosi nei suoi rami terminali. Nel suo decorso emette esili rami collaterali per parte della regione del trigono retromolare, per le ghiandole sottomandibolare e sottolinguale, ed infine emette il nervo sottolinguale che si distribuisce alla mucosa del pavimento orale ed alla superficie linguale della gengiva degli elementi dentali inferiori. Emette inoltre un ramo collaterale che si anastomizza con il nervo miloioideo
Nervo alveolare inferiore
Presenta fibre sensitive somatiche e motrici somatiche. Ha un decorso parallelo a quello del nervo linguale. Giunto tra il muscolo pterigoideo interno e la faccia mediale del ramo della mandibola, il nervo alveolare inferiore dopo aver fornito come ramo collaterale il nervo miloioideo, si immette nel canale mandibolare entrando nel corpo mandibolare attraverso l’omonimo forame a livello della spina di Spix con un diametro nervoso di circa 2.4 mm. All’interno del canale mandibolare il nervo alveolare inferiore emette come rami collaterali i nervi dentali infero-posteriori che, insieme ai nervi dentali infero-anteriori (terminali del nervo incisivo), costituiscono il plesso per l’emiarcatagengivo-dentale inferiore. Nel suo decorso all’interno del canale in corrispondenza del terzo molare questo risulta molto vicino alla corticale buccale. Il nervo alveolare inferiore continua il suo decorso all’interno del canale mandibolare e giunge al foro mentale, dividendosi nei suoi rami terminali: il nervo mentoniero e il nervo incisale.
Nervo mentoniero
Il nervo mentale fuoriesce dal canale della mandibola tramite il foro mentale. I rami labiali decorrono immediatamente sottomucosi adagiati sul piano muscolare, per poi andare ad innervare la componente cutanea del labbro inferiore e del mento.
Nervo incisale
Il nervo incisale si dirige verso la sinfisi del mento, dove si divide nei nervi dentali infero- anteriori.
Nervo infraorbitario
Ramo terminale del nervo mascellare, seconda branca del trigemino, fuoriesce dall’omonimo canale impegnando il foro infraorbitario dividendosi in rami ascendenti (per la cute e la congiuntiva della palpebra inferiore), mediali (per la cute dell’ala del naso e la tonaca mucosa del vestibolo della fossa nasale) e discendenti (per la cute e la mucosa del labbro superiore e della mucosa gengivale). Dopo la sua fuoriuscita dal forame infraorbitario ed un decorso profondo nel tessuto adiposo sopraperiosteo, alcuni rami decorrono tra piano muscolare e piano sottomucoso andando ad innervare il versante mucoso del labbro superiore, mentre altri rami sensitivi attraversano l’anello muscolare mimico o modiolo (costituito dai muscoli orbicolare della bocca, piccolo e grande zigomatico, elevatore del labbro superiore, elevatore del labbro e dell’ala nasale, canino, risorio e depressore dell’ala del naso) e, decorrendo tra piano muscolare e piano sottocutaneo, vanno ad innervare la componente cutanea del labbro superiore. Il nervo infraorbitario nel suo decorso intraosseo fornisce come ramo collaterale il nervo alveolare antero-superiore.
Nervo zigomatico
Ramo collaterale del nervo mascellare va ad innervare la cute e la regione temporale anteriore. Questo decorre all’interno di un canale a forma di Y che attraversa l’osso zigomatico dalla faccia mediale concava alla faccia laterale convessa dello stesso; quest’ultima presenta l’emergenza del nervo dall’omonimo forame. Il canale ha inizio in corrispondenza del foro zigomatico-orbitario (nella faccia orbitaria dell’osso) e si biforca in due rami di cui uno si apre sulla faccia laterale (nervo zigomatico-faciale) e l’altro sulla faccia temporale (nervo zigomatico-temporale). Il primo veicola la sensibilità della cute della regione zigomatica, il secondo della parte anteriore della regione temporale.
Nervo naso palatino
Ramo terminale del nervo mascellare decorre nel forame incisivo da cui fuoriesce insieme al fascio vascolare (arteria e vena nasopalatina). Una lesione di tale nervo genera una sintomatologia di scarsa rilevanza per la rapida ripresa della sensibilità dovuta alle anastomosi provenienti dal nervo palatino maggiore. Il nervo mascellare emette inoltre quattro rami collaterali: nervo meningeo medio, nervi sfenopalatini, il nervo zigomatico ed i nervi alveolari supero-posteriori. Questi ultimi, originati nella fossa pterigopalatina dal nervo mascellare, affondano nei canalicoli ossei della tuberosità dell’osso mascellare. Terminano anastomizzandosi con i nervi collaterali del nervo alveolare anterosuperiore con i quali formano il plesso alveolare superiore deputato all’innervazione di elementi dentali, parodonto e gengiva dell’arcata dentale superiore.
Nervo palatino maggiore
Branca del ganglio pterigopalatino, veicola sia fibre sensitive di competenza del nervo mascellare che fibre parasimpatiche. Corre nel canale omonimo fuoriesce a livello del palato duro dal forame palatino maggiore in prossimità degli incisivi. Veicola la sensibilità dell’arcata gengivale, della mucosa e delle ghiandole del palato duro e si anastomizza con rami terminali del nervo nasopalatino. Durante il suo decorso nel canale pterigopalatino, emette rami nasali inferiori, posteriori e laterali che entrano nella cavità nasale attraverso l’osso palatino arrivando fino ai meati inferiore e medio; alla sua uscita dal canale, un ulteriore ramo palatino si distribuisce al palato molle. [11]
Classificazione
Numerose sono le classificazioni proposte in letteratura circa le lesioni dei nervi periferici. Tra quelle più utilizzate c’è la classificazione secondo Seddon (1943): [12]
- Neuroaprassia: danno lieve, generalmente soggetto a recupero spontaneo completo entro poche ore/giorni; si caratterizza per l’assenza di lesioni macroscopicamente evidenti, mentre l’indagine al microscopio mostra alterazioni della guaina mielinica associate a edema tissutale. Il processo di rigenerazione nervosa comincia entro poche ore e procede dal centro verso la periferia alla velocità di 1mm/die. La rigenerazione nervosa pertanto è tanto migliore quanto più si è in prossimità dell’evento lesivo.
- Assonotmesi: danno nervoso di maggiore gravità, caratterizzato dall’interruzione completa della guaina mielinica e degli assoni senza però alcun coinvolgimento dei foglietti connettivali (Endonevrio, Perinevrio e Epinevrio) che rimangono intatti. Macroscopicamente non vi è interruzione della struttura nervosa. Il processo di degenerazione Walleriana ha in genere inizio, mentre il processo di riparazione nervosa è possibile proprio grazie all’integrità della struttura connettivale esterna che funge da guida per la rigenerazione nervosa. La prognosi è buona, con possibilità di recupero spontaneo in un tempo compreso tra poche settimane e alcuni mesi.
- Neurotmesi: si tratta del tipo di lesione più grave caratterizzato dalla completa interruzione visibile anche macroscopicamente della continuità del nervo. La ripresa spontanea può avere luogo solo se i due monconi nervosi si trovano giustapposti (chirurgicamente), in caso contrario, il gap tra i due verrà colmato da tessuto cicatriziale che renderà il recupero spontaneo pressoché impossibile. Fa eccezione il caso in il nervo sia in un canale osseo ed i due monconi nervosi siano in stretta vicinanza tra loro (come nel caso di lesione del NAI nel tratto compreso nel canale mandibolare): in questo caso la rigenerazione assonale non può che progredire dal moncone prossimale in direzione di quello distale. In questo caso il 30-40% delle fibre assonali non è in grado di oltrepassare il gap nervoso ed il recupero spontaneo non è mai completo. Il tempo necessario perché ciò avvenga è di circa 24 mesi, con la gran parte della rigenerazione che si espleta nei primi 12 mesi.
Valutazione clinica
Da un punto di vista clinico è molto utile distinguere le lesioni nervose sulla base della sintomatologia che il paziente riporta, perché orienta in modo decisivo il trattamento. In particolar modo si possono distinguere in:
- lesioni nervose non dolorose: caratterizzata dalla presenza di sintomatologia negativa (ipoestesia o anestesia tattile, termica, dolorifica, propriocettiva) o sintomi positivi (disestesie e parestesie) di lieve entità .
- lesioni nervose dolorose caratterizzate dalla presenza di sintomi diversi che vanno dalla presenza di dolore spontaneo,parossistico o continuo, alla presenza di allodinia e/o di iperalgesia. Il dolore è spesso definito come urente, puntorio, costrittivo o a scarica elettrica.
- lesioni nervose parestesiche di diverso tipo e grado intermedio tra le due precedenti.
Tabella 1. Glossario dei sintomi e segni presenti nel dolore neuropatico [13]
| Segni e sintomi negativi | Definizione |
| Ipoestesia tattile/termica/propriocettiva | Riduzione della sensibilità tattile, termica o propriocettiva |
| Ipopallestesia | Riduzione della sensibilità vibratoria |
| Ipoalgesia | Riduzione della sensibilità dolorifica |
| Dolore e sintomi positivi | Definizione |
| Parestesie | Sensazione spontanea o evocata non dolorosa (spesso descritta come “formicolio”) |
| Disestesie | Sensazione anormale spiacevole, spontanea o evocata |
| Dolore parossistico | Attacchi di dolore con caratteristiche a scarica elettrica della durata di secondi |
| Allodinia | Sensazione dolorosa evocata da uno stimolo non dolorifico. Può essere evocata da uno stimolo meccanico statico (es. pressione delicata sulla cute) o dinamico (es. sfioramento leggero della superficie cutanea con una garza), da uno stimolo termico caldo (40°C) o freddo (20°C). |
| Iperalgesia | Incrementata risposta a uno stimolo doloroso (es. strumento appuntito/filamento di Von Frey) |
| Sommazione temporale o wind-up phenomenon | L’applicazione ripetuta di un singolo identico stimolo dolorifico è percepita come una sensazione dolorosa di crescente intensità |
| Aftersensation | Persistenza della percezione dello stimolo (doloroso, ma non solo) anche dopo che esso viene rimosso |
Iter diagnostico
Valutazione clinica
Raccolta anamnestica, atta a indagare l’eziologia, la sintomatologia presente, la tempistica di comparsa della stessa rispetto all’evento ritenuto lesivo e la sua eventuale evoluzione. Il gold standard in termini di risultati funzionali sarebbe identificare immediatamente l’avvenuta lesione, così come avviene in corso di chirurgia maggiore (ortognatica, oncologica, etc.) così da poter porre immediatamente rimedio mediante una neurorrafia diretta del nervo lesionato. Purtroppo però questa evenienza accade di rado, e ci si rende conto del danno nervoso solo quando il paziente presenta alterata sensibilità i giorni successivi all’intervento. A tal punto però non è più possibile stabilire se il nervo è stato sezionato oppure se sia stato solamente compresso o stirato durante l’intervento, pertanto il paziente dovrà essere monitorato per porre diagnosi osservando l’evoluzione della sintomatologia nel tempo. [14]
Esame obiettivo del cavo orale e della cute innervata dai nervi mentoniero, infraorbitario e zigomatico per andare a delineare l’area interessata e identificare eventuali trigger che scatenano la sintomatologia (ad esempio è patognomonico di lesione del NL la presenza di un’area dolorosa premendo un centimetro postero-cranialmente all’alveolo dell’VIII). In caso di lesione del NAI è utile segnare con un pennarello sulla cute l’area interessata dal danno sensitivo. [3]
Valutazione dei dolori nei pazienti affetti secondo scale validate. Si suggerisce la DN4: [15]

Test neurosensoriali: andrebbero sempre documentati mediante la raccolta di materiale video-fotografico, previo consenso del paziente (test della pressione delicata; test dello strofinamento; test di discriminazione tra due punti). Si chiede, con il paziente ad occhi chiusi, una valutazione soggettiva e comparativa tra il lato sano e quello patologico: si toccano in modo simmetrico le due aree, e si chiede di dire il valore dal lato patologico, considerando 10 il valore del lato sano. [1-3,5,7,8,14,16] Nel territorio cutaneo di dolore possono essere valutati i segni positivi e negativi studiando le sensibilità tattile (sfioramento con garza o pennello) e meccanica pressoria e termica al freddo (oggetto metallico a temperatura ambiente o in frigorifero) e al caldo (Thermo test o provetta riempita con acqua calda).Potremo trovare solo segni positivi (allodinia, iperalgesia), solo segni negativi o un mix di questi. Per la definizione di dolore neuropatico, è necessaria la presenza di segni postivi o negativi; fa eccezione la nevralgia trigeminale. [17]
Valutazione neurofisiologica
Sebbene in letteratura siano state proposte diverse metodiche di esame neurofisiologico per la valutazione del danno tronculare sensitivo in ambito oro-facciale (SEP, conduzione sensitiva, Blink Reflex), l’esperienza acquisita nella diagnosi e nel follow-up dei pazienti nel corso di questi anni ha considerato l’esecuzione del Riflesso Inibitorio Masseterino- MIR, preceduto dalla valutazione delle soglie di sensibilità tattile e dolorifica, come la metodica migliore per la sua facilità e rapidità di esecuzione ambulatoriale e corrispondenza con i dati clinici e chirurgici.
A dati momenti del protocollo proposto di seguito, viene valutata la Soglia soggettiva di percezione dello stimolo elettrico tattile e dolorifico ed il Riflesso Inibitorio Masseterino – MIR.1-3,13-15 + 1a-2a-3a-4 Una buona corrispondenza con i dati clinici e con l’esperienza pre e post operatoria è ottenuta con lo studio del Riflesso Inibitorio Masseterino (MIR- Masseter Inhibitory Reflex) che corrisponde all’inibizione della muscolatura masticatoria se viene erogato uno stimolo fastidioso in zona periorale/orale. La stimolazione elettrica periorale o intra orale durante attività volontaria di chiusura con attivazione bilaterale dei muscoli massetere provoca, anche se applicata monolateralmente, una brusca riduzione del reclutamento muscolare e del segnale elettromiografico, con due periodi di inibizione o “silenzio” detti Sp1, a breve latenza, e Sp2 a più lunga latenza. La stimolazione di un territorio ipo o anestesico, per effetto del deficit di percezione come nel caso di una sofferenza tronculare del nervo infraorbitario, alveolare inferiore e linguale, non sarà capace di produrre risposte o, se presenti risulteranno alterate con tempo di comparsa (latenza) aumentata e ridotta soppressione del segnale elettromiografico. Queste risposte tendono a ricomparire e a riorganizzarsi quando il nervo ricresce con ripresa della sensibilità a seguito di recupero spontaneo o dopo microchirurgia riparativa. Lo studio del Riflesso Inibitorio Masseterino – MIR è preceduto nella metodica da noi usata da una valutazione della soglia soggettiva di percezione dello stimolo elettrico tattile e dolorifico. La valutazione si effettua sempre a partire dal lato sano e da altri territori trigeminali non coinvolti nel danno, in modo da avere un valore di riferimento. Lo stimolo viene erogato a partire da un’intensità pari a zero e aumentato con piccoli incrementi (si usa come parametro la scala dei milliAmpére – mA) sino a che il Paziente non percepisce chiaramente una sensazione tattile, come uno sfioramento lieve. La prova viene effettuata ripetutamente (almeno 5 volte) per ottenere il valore di intensità medio espresso in mA che costituisce il valore di soglia sensitiva tattile. Poi si incrementa l’intensità sino al punto in cui la sensazione diviene pungente, come una puntura elettrica, e si raccoglie il valore medio come precedentemente fatto con la soglia tattile per esprimere il valore di soglia dolorifica. Ottenuto questo valore, con stimoli incrementali, si arriva a ottenere delle risposte riflesse stabilizzate. La procedura viene poi applicata sul lato affetto dove spesso non si ottengono risposte valutabili per effetto del grave deficit sensitivo. Tale procedura è inoltre applicata anche ad altri territori, ipsilaterali e controlaterali alla sede di danno, poiché è sempre meglio verificare che non ci si trovi di fronte a un deficit di funzione trigeminale più esteso e attribuibile ad altra causa che non sia la sofferenza tronculare che si sta valutando. La valutazione delle soglia di percezione tattile e dolorifica varia in valore assoluto di milliAmpére a seconda del tipo di stimolatore utilizzato (agoelettrodi, stimolatori a microsfere, etc.) per effetto dell’impedenza e della resistenza cutanea, ma quello che è importante è il confronto tra lato affetto e lato sano per esprimere una ratio o un valore percentuale che corrisponda alla capacità sensitiva residua che si può valutare nel territorio nervoso dove è presente un’alterazione di funzione con deficit sensoriale. Per esempio, se, dopo avere delimitato con l’esame clinico di sensibilità l’area cutanea del mento di pertinenza del nervo alveolare inferiore ipofunzionante, in questa zona l’intensità di corrente dello stimolo necessaria per evocare una sensazione tattile sarà espressa in 3 milliAmpére (soglia tattile) e l’intensità di corrente per ottenere una sensazione dolorosa sarà 11 milliAmpére (soglia dolorifica), mentre sul lato sano le stesse saranno rispettivamente di 1 milliAmpére (soglia tattile) e 4 milliAmpére (soglia dolorifica), si potrà calcolare la percentuale di capacità sensitiva residua del territorio nervoso affetto con una semplice operazione di calcolo percentuale. Capacità tattile residua lato affetto – 1:2 x 100 = 33.3% rispetto al lato sano. Capacità dolorifica residua lato affetto – 4:11 x 100 = 36,3% rispetto al lato sano. La metodica neurofisiologica descritta valuta modalità sensoriali semplici (tatto, dolore) con buona corrispondenza e affidabilità nell’oggettivare il danno tronculare e la sua evoluzione di riparazione spontanea o microchirurgica. [18-20]
Iter terapeutico
Fondamentale nella gestione di questi pazienti è il corretto follow-up ed il timing dell’intervento. Il gold standard è ovviamente rappresentato dalla ricostruzione microchirurgica immediata, in corso dello stesso intervento risultato lesivo per il nervo stesso.[1-3,14]
Purtroppo questo situazione si presenta molto di rado (lesioni spesso prodotte in corso di chirurgia ambulatoriale con campi operatori che non espongono direttamente i nervi: ne consegue l’inconsapevolezza della lesione durante la procedura di estrazione dell’ottavo oppure di posizionamento dell’impianto).
Ci sono alcune situazioni che richiedono un intervento immediato:
- La presenza del sintomo dolore (non il consueto dolore nella sede di ferita, che si risolve normalmente in un breve lasso di tempo, ma nel territorio di competenza del nervo). I risultati sono statisticamente migliori in caso di intervento precoce (ed inoltre si espone il paziente per un minor lasso di tempo alla riduzione grave della qualità della vita). Ciononostante è possibile ottenere risultati positivi anche a distanza di anni dall’insorgenza delle algie;
- La presenza nel canale mandibolare di corpi estranei (impianto dentario, radice dentaria, corpo estraneo) comporta la necessità di rimuoverli sia per eliminare lo stimolo irritativo, sia per consentire la spontanea rigenerazione assonale nel canale stesso;
- Certezza della sezione del nervo: questo è evento raro, in genere in corso di chirurgia maggiore (oncologica, ortognatica, traumatologia). In questi casi l’intervento immediato permette di ottenere i migliori risultati funzionali possibili.
In caso di assenza di algie e di informazioni certe circa la sezione del nervo, occorre attendere per dare al nervo interessato la possibilità di un recupero spontaneo (neuraprassia, neurotmesi o lesione dell’alveolare inferiore nel canale), tenendo sempre in considerazione che meno tempo si lascia trascorrere dall’evento lesivo e ipoteticamente migliori saranno i risultati in termini funzionali. Questo perché la spontanea rigenerazione nervosa è più vivace a ridosso del momento della lesione. E’ peraltro vero che non si ha un termine certo di esaurimento della rigenerazione nervosa, e pertanto è possibile effettuare il trattamento ricostruttivo anche a distanza di numerosi anni dal momento della lesione, tenendo conto però che non si può contare su pari garanzia di risultato.
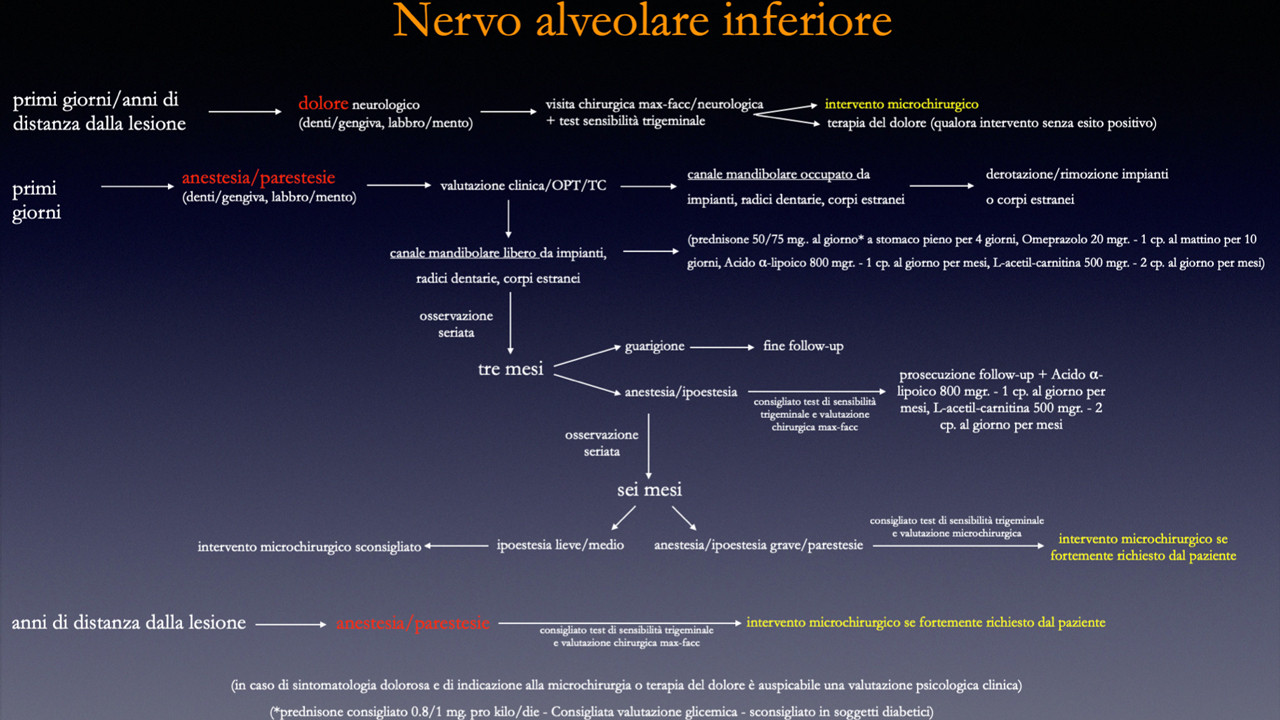
Subito dopo l’evento lesivo è buona norma prescrivere integratori a base di Acido α- Lipoico, L-acetilcarnitina, Vitamine del Gruppo B per un periodo massimo di alcuni mesi. Agli integratori, se necessario si possono associare ansiolitici e antidolorifici. In caso di un nervo contenuto in un canale osseo, tipicamente il NAI, è utile associare una terapia corticosteroidea ad alte dosi per alcuni giorni, con adeguata copertura gastrica (ad esempio: prednisone consigliato 0.8/1 mg. pro kilo/die + omeprazolo 20 mg/die). La terapia corticosteroidea ad alte dosi riduce il tempo di ischemia del nervo dovuto al suo edema postraumatico che ne determina la compressione sulle pareti del canale. In caso di lesione extraossea (lesione del NL ad esempio), la terapia cortisonica appare inutile in quanto l’edema del nervo nei tessuti molli non determina alcuna compressione né ischemia dello stesso.
A seguire, si rende necessario rivedere il paziente ripetutamente nel tempo per monitorare l’andamento della sintomatologia clinica e decidere di conseguenza se e come intervenire. Ai pazienti affetti da algie o parestesie fortemente disturbanti, e a coloro che sono candidati ad interventi chirurgici è suggeribile proporre una valutazione psicologica, cui potrà seguire un percorso specifico di trattamento. [1,2]
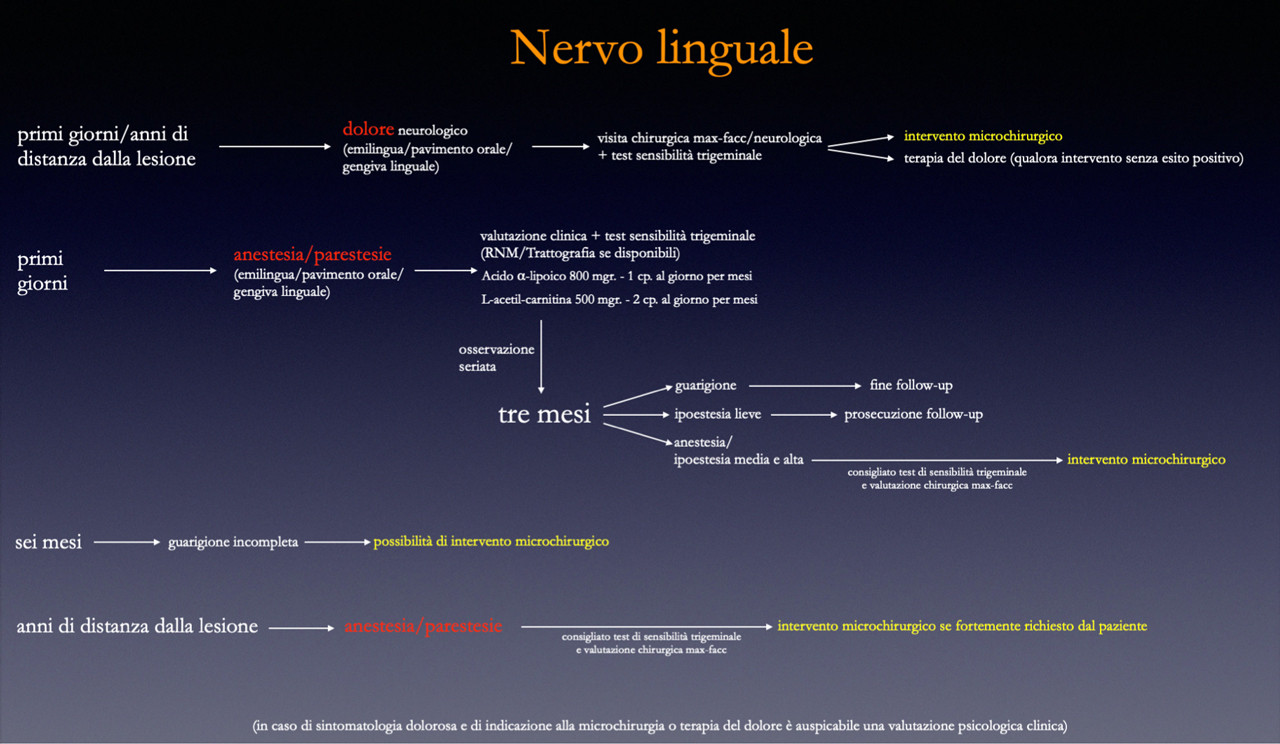
Schema terapeutico
- tempo zero: valutazione clinica, strumentale, somministrazione di integratori (L- acetilcarnitina, a. alfalipoico, Vit. B), test clinici, eventuale terapia psicologica e farmacologica da parte di specialista in terapia del dolore;
- prime settimane: rivalutazioni cliniche ogni 2-3 settimane. Indicazione all’intervento in caso di dolore neurologico (non della sede di intervento ma del territorio di innervazione);
- 3 mesi: test di sensibilità trigeminale e indicazione alla ricostruzione del nervo linguale se non c’è stato ampio recupero/risoluzione completa della sintomatologia.
- 6 mesi: possibile indicazione all’intervento per il nervo linguale ancora parzialmente deficitario, oppure per il nervo alveolare inferiore completamente deficitario se lo richiede il paziente. E’ possibile porre indicazione all’intervento microchirurgico anche nel caso in cui il paziente con parestesie fortemente disturbanti lo richieda. L’intervento di ricostruzione nervosa può essere indicato anche a distanza di anni dall’insorgenza della lesione. Va infatti ricordato che ci sono metodiche microchirurgiche innovative di reclutamento di fibre assonali da fonti nervose alternative che permettono di estendere i limiti temporali di intervento teoricamente a tempo indeterminato. [21,22]
- anni dall’evento traumatico: c’è indicazione in caso di algie, spiegando al paziente che le possibilità di successo sono ipoteticamente inferiori rispetto ad un intervento precoce. Lo stesso in caso di anestesia completa condizionante negativamente la qualità di vita del paziente.
Trattamento Microchirurgico
Le tipologie di intervento microchirurgico consigliate sono la neurorrafia diretta e la sostituzione del tratto di nervo lesionato con innesto nervoso (autologo o di banca). [1-3,7,14,23-25] Alternative scientificamente meno efficaci sono l’innesto venoso, e sostituti nervosi alloplastici. [14,26-28] E’ possibile effettuare neurolisi e decompressione dei nervi.
È indicata la rimozione di materiale endodontico dal canale mandibolare in caso di algie e parestesie di grado medio/elevato. [23]
I risultati della microchirurgia ricostruttiva sono ben documentati i letteratura scientifica, ma deve essere spiegato al paziente che non esiste garanzia assoluta degli stessi.
Terapia del dolore
Pazienti affetti da croniche, fallimenti di trattamenti microchirurgici per la correzione di algie ad eziologia iatrogena, o situazioni algiche in cui il trattamento microchirurgico non sia possibile né indicato, devono essere indirizzati al terapista del dolore che presenta nel suo armamentario terapeutico diverse opzioni: [29,30]
- Farmacologico (antiepilettici, antidepressivi, inibitori selettivi della ricaptazione della serotonina e noradrenalina, oppioidi, etc.)
- Blocchi anestetici (scopo terapeutico temporaneo/predittivo)
- Tecniche di neuromodulazione: Radiofrequenza pulsata sul nervo periferico o a livello del ganglio di Gasser – Criomodulazione (Crioanalgesia)–Radiofrequenza continua a livello del ganglio di Gasser – GammaKnife
- Psicologia clinica
- Metodiche con effetto sulla sfera emozionale (aumento del coping) : ipnosi, agopuntura,stimolazione elettrica o magnetica, etc.
Follow up
Il paziente deve venir rivalutato periodicamente per un tempo limite di due anni in assenza di algie e parestesie fortemente disturbanti. I pazienti con sintomatologia algica, devono viceversa essere tenuti sotto controllo medico del dolore constante per l’eventuale rimodulazione dei farmaci, ripetizione delle procedure terapeutiche per il controllo dei dolori, applicazione di altri rimedi terapeutici.
La rigenerazione nervosa può essere considerata avvenuta per gran parte ad un anno, in modo pressoché definitivo a due anni. In realtà una piccola parte di rigenerazione e rimodulazione della sensibilità può avvenire anche nei 7-8 anni successivi. [3,14]
Bibliografia
1. Biglioli F, Allevi F, Lozza A. Inquadramento, follow up e terapia delle lesioni del nervo alveolare inferiore. Dentista Moderno. 2014; 4:46-60
2. Biglioli F, Allevi F, Lozza A. Diagnosi, trattamento e follow up delle lesioni trigeminali del cavo orale. Dental Cadmos. 2014; 82:89-106
3. Biglioli F, Lozza A, Colletti G, et al. Objective assessment of lingual nerve microsurgical reconstruction. J CraniofacSurg, 2018; 29:740-744
4. Cheung LK, Leung YY, Chow LK, Wong MC, Chan EK, Fok YH. Incidence of neurosensory deficits and recovery after lower third molar surgery: a prospective clinical study of 4338 cases. Int J Oral Maxillofac Surg. 2010 Apr;39(4):320-6
5. Hillerup S. Iatrogenic injury to the inferior alveolar nerve: etiology, signs and symptoms and observation on recovery. Int J OralMaxillofac Surg. 2008; 17:704-709
6. Cheung LK, Leung YY, Chow LK, Wong MCM, Chan EKK, Fok YH. Inferior alveolar nerve damage after lower third molar surgical extraction: a prospective study of 1117 surgical extractions. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001 Oct;92(4):377-83
7. Biglioli F, Colletti G. Protocollo diagnostico e terapeutico dei danni neurologici a carico del nervo alveolare inferiore nella chirurgia dell’ottavo. Il Dentista Moderno. 2006; 128-137
8. Miloro M. Trigeminal Nerve Injuries, DOI 10.1007/978-3-642-35539-4_13, Springer-Verlag Berlin Heidelberg 2013
9. Knowles KI, Jergenson MA, Howard JH. Paraesthesia associated with endodontic treatment of mandibular premolars. J Endod. 2003;29:768–770
10. Ilana Shavit, Gintaras Juodzbalys. Inferior alveolar nerve injuries following
implant placement – importance of early diagnosis and treatment: a systematic
review. J Oral Maxillofac Res. 2014;Dec 29;5(4):e2
11. Coprivez P, Lozza A, Pistilli R, et al. Lesioni del nervo trigemino: anatomia,
clinica, valutazione. Oris Broker Editore. Gennaio 2021
12. Seddon HJ. Three types of nerve injury. Brain. 1943; 66:237-288
13. Baron R. Mechanisms of Disease: neuropathic pain—a clinical perspective. Nat
Rev Neurol 2, 95–106,2006
14. Biglioli F, Allevi F, Lozza A. Surgical treatment of painful lesions of the inferior
alveolar nerve. J CraniomaxillofacSurg. 2015; 43:1541-1545
15. Bouhassira D, Attal N, Alchaar H, Boureau F, Brochet B, Bruxelle J, Cunin G, Fermanian J, Ginies P, Grun-Overdyking A, Jafari-Schluep H, Lantéri-Minet M, Laurent B, Mick G, Serrie A, Valade D, Vicaut E. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain. 2005 Mar;114(1-2):29-36
16. Kim YK, Yun PY, Kim JH, et al. The quantitative sensory testing is an efficient objective method for assessment of nerve injury. MaxillofacPlastReconstrSurg. 2015; 37:13
17. Finnerup NB, Kuner R, Jensen TS. Neuropathic Pain: From Mechanisms to Treatment. PhysiologicalReviews (2021),101(1): 259-301
18. Biasotta A, Cascone P, Cecchi R, et al. Iatrogenic damage to the mandibular nerve as assessed by the masseter inhibitory reflex. J HeadachePain. 2011; 12:485-488
19. Cabib C, Biglioli F, Valls-Solé J. Traumatic lingual nerve injury assessed by sensory threshold and masseter inhibitory reflex. J Neurol. 2013;260
20. Cruccu G, Inghilleri M, Fraioli B, et al. Neurophysiological assessment of trigemina function after surgery for trigemino neuralgia. Neurology 1987; 37:631-638
21. Biglioli F, Allevi F, Colletti G, et al. Cross-tongue procedure: a new treatment for long-standing numbness of the tongue. Br J OralMaxillofac Surg. 2015; 53:880-882
22. Gennaro P, Gabriele G, Mihara M, Kikuchi K, De Caris F. Side-to-end trigeminal to trigeminal fascicular neurorrhaphy to restore lingual sensibility: a new technique . J Reconstr Microsurg. 2014 Mar;30(3):211-4
23. Biglioli F, Kutanovaite O, Autelitano L, et al. Surgical treatment of painful inferior alveolar nerve injuries following endodontic treatment: a consecutive case series of seven patients. OralMaxillofacSurg. 2017; 21:461-466
24. Squintani G, Bonetti B, Paolin A, et al. Nerve regeneration across cryopreserved allografts from cadaveric donors: a novel approach for peripheral nerve reconstruction. J Neurosurg. 2013; 119:907-913
25. Cicconetti A, Matteini C, Giorgio Cruccu G, Romaniello A. Comparative study on sensory recovery after oral cavity reconstruction by free flaps: preliminary results. Journal of Cranio-Maxillofacial Surgery (2000) 28, 74±78
26. Pogrel MA, Maghen A. The use of autogenous vein graft for inferior alveolar and lingual nerve reconstruction. J OralMaxillofacSurg. 2001; 59:985-988
27. Meyer RA, Bagheri SC. A bioabsorbable collagen nerve cuff (NeuraGen) for repair of lingual and inferior alveolar nerve injuries: a case series. J OralMaxillofacSurg. 2009; 67:2550-2551
28. Pabari A, Lloyd-Hughes H, Seifalian AM, et al. Nerve conduits for peripheral nerve surgery. PlastReconstrSurg. 2014; 133:1420-1430
29. Bendtsen L, Zakrzewska JM, Heinskou TB, Hodaie M, Lacerda Leal PR, Nurmikko T, Obermann M, Cruccu G, Maarbjerg S. Advances in diagnosis, classification, pathophysiology, and management of trigeminal neuralgia
Lancet Neurol 2020; 19: 784–96
30. Cruccu G, Iannetti GD, Marx JJ, Thoemke F, Truini A, Fitzek S, Galeotti F, Urban PP, Romaniello A, Stoeter P, Hopf HC.Brainstem reflex circuits revisited. Brain (2005), 128, 386–394
31. Aramideh M, Ongerboer de Visser BW. Brainstem reflexes: electrodiagnostic techniques, physiology, normative data, and clinical applications.Muscle Nerve. 2002 Jul;26(1):14-30
