
Raccomandazioni di buona pratica clinica per la cura delle paralisi facciali
Coordinatore:
- Biglioli Federico, Professore Ordinario e Direttore della Scuola di Specializ- zazione in Chirurgia Maxillo-Facciale, Dipartimento di Scienze della Salute, Università de- gli Studi di Milano; Direttore dell’UO Complessa di Chirurgia Maxillo-Facciale dell’ASST Santi Paolo e Carlo di Milano
Gruppo di lavoro:
- Allevi Fabiana, Ricercatore Universitario, Dipartimento di Scienze della Salute, Università degli Studi di Milano; Specialista in Chirurgia Maxillo-Facciale presso l’UO di Chirurgia Maxillo-Facciale – ASST Santi Paolo e Carlo di Milano
- Bianchi Bernardo, Specialista in Chirurgia Maxillo-Facciale, Dirigente Medico presso l’Uni- tà Operativa di Chirurgia Maxillo-Facciale dell’Azienda Ospedaliero-Universitaria di Parma
- Bolognesi Federico, Specialistica in Chirurgia Maxillo-Facciale presso l’Unità Operativa di Chirurgia Maxillo-Facciale del Policlinico S. Orsola – Malpighi, Bologna Alma Mater Studio- rum – Università di Bologna
- Copelli Chiara, Professore Associato di Chirurgia Maxillo-Facciale presso l’Università degli Studi di Torino; Specialista in Chirurgia Maxillo-Facciale presso AOU Città della Salute e della Scienza di Torino – Sede Molinette
- Cupello Silvia Maria, Fisioterapista presso l’Unità Operativa di Riabilitazione Specialistica dell’ASST Santi Paolo e Carlo di Milano, Professore a Contratto presso l’Università degli Studi di Milano
- Dalla Toffola Elena, Professore Ordinario presso la Facoltà di Medicina e Chirurgia dell’U- niversità di Pavia nella disciplina Medicina Fisica e Riabilitazione, Specialista in Chinesite- rapia, Fisioterapia, Riabilitazione e Ginnastica Medica in Ortopedia, in Neurologia e in Idrologia Medica
- De Donato Giuseppe, Specialista in Otorinolaringoiatria, Dirigente medico e Responsabile della Otochirurgia, della Chirurgia delle Protesi impiantabili e degli Impianti Cocleari presso l’Unità Operativa di Otorinolaringoiatria dell’ASST Santi Paolo e Carlo di Milano
- De Ruvo Valentino, Medico Specializzando presso l’Unità Operativa di Oftalmologia del- l’ASST Santi Paolo e Carlo di Milano, Università degli Studi di Milano
- Della Monaca Marco, Ricercatore Universitario presso l’Università Sapienza di Roma; Specialista in Chirurgia Maxillo-Facciale presso l’Unità Operativa di Chirurgia oncologica e ricostruttiva Maxillo-Facciale del Policlinico Universitario Umberto I, Roma
- Ferri Andrea, Specialista in Chirurgia Maxillo-Facciale presso l’Unità Operativa di Chirurgia Maxillo-Facciale dell’Azienda Ospedaliero-Universitaria di Parma Ferroli Paolo, Specialista in Neurochirurgia, Direttore dell’Unità Operativa Neurochirurgia 2 presso la Fondazione Istituto Neurologico C. Besta
- Fogagnolo Paolo, Ricercatore Universitario, Dipartimento di Scienze della Salute, Univer- sità degli Studi di Milano; Specialista in Oftalmologia presso l’UO di Oftalmologia – ASST Santi Paolo e Carlo di Milano
- Gennaro Paolo, Professore Associato presso Dipartimento di Biotecnologie Mediche, Uni- versità degli Studi di Siena; Responsabile dell’UO Chirurgia Maxillo-Facciale dell’Azienda Ospedaliero-Universitaria Senese
- Giannaccare Giuseppe, Professore Associato di Oftalmologia presso l’Università Magna Graecia di Catanzaro, Dirigente Medico presso l’Unità Operativa di Oculistica del Policlini- co Mater Domini di Catanzaro
- Lozza Alessandro, Specialista in Neurologia, Libero Professionista svolge attività di Con- sulente Medico e Scientifico; Professore a contratto presso l’Università degli Studi di Mila- no, di Sassari, di Pavia e dell’Università dell’Insubria
- Mariani Vera, Psicologa e Psicoterapeuta presso l’Unità Operativa di Psicologia Clinica dell’ASST Santi Paolo e Carlo di Milano
- Mortini Pietro, Professore Ordinario di Neurochirurgia presso l’Università Vita-Salute San Raffaele di Milano; Direttore dell’Unità Operativa di Neurochirurgia e Radiochirurgia Ste- reotassica presso l’IRCCS Ospedale San Raffaele di Milano
- Previtera Antonino Michele, Professore Associato in Medicina Fisica e Riabilitativa presso l’Università degli Studi di Milano, Direttore dell’Unità Operativa di Riabilitazione Specialisti- ca dell’ASST Santi Paolo e Carlo di Milano
- Rabbiosi Dimitri, Specialista in Chirurgia Maxillo-Facciale, Dirigente Medico presso l’UO di Chirurgia Maxillo-Facciale – ASST Santi Paolo e Carlo di Milano
- Salimbeni Grazia, Specialista in Chirurgia Plastica e Ricostruttiva presso la Casa di Cura San Rossore a Pisa e presso la Casa di Cura Santa Zita a Lucca. Professore a Contratto presso la Clinica Otorinolaringoiatria dell’Università di Pisa come docente di Microchirurgia Ricostruttiva del Distretto Cervico-Facciale
- Valentini Valentino, Professore Ordinario e Direttore della Scuola di Specializzazione in Chirurgia Maxillo-Facciale, Università Sapienza di Roma; Direttore dell’Unità Operativa di Chirurgia Oncologica, Ricostruttiva Maxillo-Facciale, presso il Policlinico Universitario Um- berto I di Roma
- Vegni Elena, Professore Associato presso il Dipartimento di Scienze della Salute, dell’Uni- versità degli Studi di Milano; Direttore dell’UO di Psicologia Clinica dell’ASST Santi Paolo e Carlo di Milano
- Zardoni Manuela, Specialista in Neurologia presso l’UO di Neurologia dell’ASST Santi Paolo e Carlo di Milano
Introduzione
La paralisi facciale è una condizione clinica estremamente invalidante sotto il profilo funzionale, estetico e psicologico. Colpisce una persona ogni 55 nel corso della vita. Le cau- se sono molteplici: congenite, ritardo di sviluppo (developmental), traumi, esiti di interventi chirurgici a livello cerebrale, della base cranica, facciali, ictus, infezioni virali ed altri ancora. La più frequente in assoluto però è la paralisi di Bell (ne soffre una persona ogni 65 nel corso della vita), impropriamente nota come “paralisi a frigore”; ha una eziologia non nota completamente (spesso associata ad infezione da Herpes Simplex, ma anche a stress psicofisici) e tende a regredire completamente nel 70% dei casi. Nel restante 30% la guarigione è parziale con esiti di vario grado: ipertono di base o ptosi dei tessuti, paresi settoriali o di tutto l’emivolto, sincinesie. Meno dell’1% dei pazienti rimane completamente paralizzato.
La gran parte delle paralisi facciali sono monolaterali. Le bilaterali sono perlopiù congenite (Sindrome di Moebius), esiti di accidenti cerebrali, traumi estesi della base cranica. Il deficit funzionale più grave associato alla paralisi è la ridotta lubrificazione corneale, legata alla mancata attivazione del muscolo orbicolare dell’occhio durante l’ammiccamento. In circa il 30% di pazienti si associa una ridotta produzione di produzione lacrimale a causa del deficit di stimolazione nervosa per la lesione delle fibre proprie, nella porzione che attraversa il nervo facciale prima di unirsi al nervo grande petroso. Altri difetti funzionali sono il ridotto campo visivo a causa della ptosi palpebrale, il deficit di respirazione nasale per il collasso mediale dell’ala del naso, difetti masticatori e di parola per la lassità dei tessuti della guancia e delle labbra. Per lo stesso motivo, a volte la perdita di saliva della bocca. Infine il cattivo sapore in bocca, dovuto alla lesione delle fibre del nervo linguale nel loro passaggio nel nervo facciale prima di inserirsi nella corda timpani.
I deficit estetici con il viso a riposo sono meno evidenti nei bambini e più marcati nelle persone con minor tono dei tessuti molli facciali. Sostanzialmente ogni regione facciale presenta ptosi verso il basso (sopracciglio, palpebra superiore ed inferiore condizionante ectropion, guancia, labbra, tessuti del mento e del collo). L’attivazione della muscolatura mimica peggiora in modo molto evidente i difetti estetici, inducendo i più a evitare di sorridere o a parlare tenendo una mano davanti alla bocca.
Relativamente alla terminologia appare opportuno sottolineare alcuni aspetti. Paralisi è l’assenza di movimento. Da non confordersi con paresi che rappresenta la riduzione dei movimenti. La paralisi flaccida presenta assenza di tono a riposo della muscolatura, senza sincinesie e iperattività. Per sincinesie facciali si intendono movimenti involontari e anomali che si accompagnano all’attivazione volontaria o spontanea della muscolatura mimica. La sindrome facciale postparalitica è costituita da un insieme di sintomi dovuti a disfunzione del nervo facciale: rigidità – spasmi – contratture – ipertono a riposo – dolore dei muscoli mimici, epifora gustativa, sincinesie. I segni possono anche essere ipotono a riposo e paresi segmentarie o diffuse.
Diagnosi
La diagnosi è fondamentale perchè orienta il clinico circa la possibilità di ripresa funzionale spontanea del nervo e anche nel timing del trattamento.
L’anamnesi porta quasi sempre alla definizione della diagnosi (trauma, intervento neurochirurgo o ORL, infezione virale, etc.). Esami specifici (TAC, RNM, angiografia, esami ematici, etc.) possono venir richiesti per completare la l’iter diagnostico. Deve essere valutata la presenza di vescicole cutanee intra- o retro-auricolari per porre eventuale diagnosi di infezione dal virus Herpes Zoster.
La Paralisi di Bell presenta insorgenza entro 72 ore, spesso evidente improvvisamente al risveglio o durante la giornata. In assenza di altri sintomi neurologici, può essere evitata l’esecuzione di una TAC cerebrale, da effettuarsi a tre mesi dall’insorgenza qualora non ci fossero segni di recupero funzionale della muscolatura mimica.
L’esame obiettivo deve valutare la situazione statica e dinamica delle diverse regioni facciali: fronte/elevazione del sopracciglio, palpebre/chiusura palpebrale, guance/sorriso mostrando in denti e senza mostrare i denti, labbra/bacio e sorriso, scopertura dei denti inferiori, collo/tensione del platisma. Fotografie ed filmati datati dei vari movimenti sono molto importanti per poter individuare i cambiamenti morfologici e funzionali del volto nel tempo.
Deve essere posta particolare attenzione alle paralisi ad insorgenza lenta e progressiva. Queste possono essere legate allo sviluppo di una piccola neoformazione a livello del ganglio genicolato/canale del facciale, o un carcinoma a livello del foro stilomastoideo. È opportuno in questi casi indagare con TAC a scansioni sottili il canale del facciale, e con una RNM con mdc dell’encefalo e della parotide, senza limitarsi ad un esame a scansioni larghe o eseguito molto tempo prima: infatti la lenta progressione della neoformazione può non farla individuare immediatamente nei primi periodi di instaurazione della paralisi.
Una visita oculistica è necessaria in caso di sofferenza corneale per diagnosticare e tratta- re le complicanze oculari che si possono determinare nei pazienti con paralisi del nervo facciale. L’approccio oculistico inizia con la valutazione dell’acuità visiva del paziente, fondamentale specialmente nel caso in cui l’occhio affetto da paralisi sia quello con un’acuità visiva maggiore del controlaterale. Si prosegue poi con l’esame alla lampada a fessura al fine di indagare gli annessi oculari, la cornea, la congiuntiva, la sclera e l’iride. Si possono ritrovare alterazioni del trofismo di queste strutture, dall’occhio secco da alterata distribuzione della lacrima fino ad ulcere corneali da esposizione. Rientra nell’iter diagnostico la valutazione dell’innervazione della cornea tramite la stimolazione diretta con un cotone per valutare se la sensibilità corneale sia conservata o meno. Un altro parametro da valutare è la produzione di lacrime attraverso il test di Schirmer. Determinante è poi la valutazione del tono della muscolatura delle palpebre ed il calcolo della distanza tra i margini palpebrali che viene calcolata in millimetri in base allo spazio presente tra i margini delle palpebre superiori ed inferiori. Va studiata anche la distanza marginale riflessa 1 (MRD-1) tra il centro del riflesso pupillare alla luce e il margine palpebrale superiore e MRD-2 è la distanza tra il centro del riflesso pupillare alla luce e il margine palpebrale inferiore. [Giannaccare et al. 2021]
Valutazione neurofisiologica
Nella valutazione della sofferenza periferica del nervo faciale gli esami indicati per la dia- gnosi, prognosi, terapia medica e/o chirurgica sono l’elettromiografia (EMG), l’elettroneurografia (ENG) e lo studio dei riflessi cranici che si esegue soprattutto con il Blink Reflex (BR). La principale valutazione per una corretta oggettivazione della sofferenza assonale del nervo è l’esame EMG che è effettuato con agoelettrodi collegati a un’apparecchiatura per EMG/ENG e che sono inseriti nei muscoli che presentano deficit motorio. Si registra l’attività a riposo (fibrillazione) che, se presente, è indice di denervazione in atto, e si registra l’attivazione volontaria quando presente e l’alterazione sia della morfologia dei potenziali elettrici delle unità motorie (PUM) ed il loro pattern di reclutamento. L’ENG prevede la stimolazione del nervo faciale al trago e la registrazione dai muscoli esaminati e con questo si ottiene la conduzione motoria potendone valutare i parametri di alterazione delle risposte ottenute (latenza, ampiezza, morfologia). Il BR si ottiene stimolando il nervo sopraorbitario o infraorbitario e si registra fisiologicamente in modo bilaterale dal muscolo orbicolare dell’occhio. Valuta l’integrazione tra la sua componente afferente trigeminale e la sua componente efferente faciale; la presenza di risposte alterate o assenti può essere utile per valutare la componente prossimale del nervo faciale mentre una sua diffusione anomala al territorio inferiore è presente nei fenomeni d’ipereccitabilità (emispasmo faciale) o nei fenomeni di reinnervazione aberrante. Nella diagnostica in fase acuta i segni significativi di tipo ed entità della sofferenza del nervo faciale sono presenti dalla terza-quarta settimana dall’insorgenza della paralisi, pertanto questo è il tempo consigliato per l’esecuzione dell’esame. Nei mesi successivi l’esame neurofisiologico è in grado di valutare se e in che modalità possa oggettivarsi una ripresa funzionale del nervo dando indicazioni per l’utilità di una terapia medica o chirurgica. Mentre l’esame diagnostico in fase acuta-subacuta può essere condotto in modo schematico valutando i muscoli del territorio superiore ed inferiore, l’esame in fase preoperatoria (in genere attorno all’8° mese, ma non solo), è eseguito in modo più puntuale valutando numerosi muscoli dell’emivolto affetto da paralisi con necessità di più inserzioni all’interno dello stesso muscolo. A questo si associa la valutazione EMG dei territori potenzialmente donatori, ipsilateralmente trigemino moto- rio e ipoglosso, contro lateralmente faciale non affetto. Anche se non è presente attività volontaria, la presenza di attività a riposo (fibrillazione) è indice della capacità del muscolo paralizzato di avere ancora proprietà elettriche di membrana e di poter ricevere una reinnervazione diretta dai nervi trasposti. Se invece, come nelle paralisi di lunga data, la fibrillazione è assente per degenerazione fibroadiposa dei muscoli, l’assenza di fenomeni elettrici sarà di supporto alla scelta del chirurgo di eseguire un trapianto di muscolo prelevato da altra zona corporea.
Timing & Trattamento
Il trattamento della paralisi facciale è spesso misconosciuto ai più, con la tendenza di gran parte dei professionisti a suggerire di attendere troppo a lungo la spontanea ripresa funzionale. Questo può compromettere l’efficacia della chirurgia ricostruttiva, o imporre una chirurgia ricostruttiva più gravosa per il paziente che comporti l’utilizzo di lembi microvascolari in vece di semplici neurorrafie.
Paralisi di Bell: la paralisi di Bell viene trattata tramite steroidi per via orale entro 72 dall’insorgenza della sintomatologia, e presidi di lubrificazione e protezione corneale. L’uso di antivirali per via orale è consigliato solo nella paralisi da Herpes Zoster (paralisi di Ramsay Hunt) e non in quella di Bell. È opzionale l’uso di integratori della rigenerazione nervosa come L-acetilcarnitina/acido alfalipoico/vitamine del gruppo B. È statisticamente non provata l’efficacia della fisioterapia nell’incrementare quantitativamente il recupero funzionale, mentre può essere efficace per ottimizzare il controllo della funzione nervosa ripristinata e la coordinazione dei movimenti (nonché dare temporanea attenuazione delle contratture muscolari).
È obbligatorio che l’oculista valuti attentamente lo stato corneale, messo alla prova dalla ridotta lubrificazione corneale ed assenza dell’ammiccamento. I rimedi terapeutici sono preferenzialmente non chirurgici e constano nell’applicazione di lacrime artificiali e gel, cerotti posti orizzontalmente a livello della palpebra superiore alla notte, utilizzo di umidificatori negli ambienti secchi. Possono essere applicati pesi palpebrali specifici con cerotti biadesivi durante il giorno per appesantire le palpebre e migliorare l’ammiccamento. Nei casi più gravi, di lesione corneale, il rimedio può essere chirurgico (lipofilling palpebrale, innesto di pesi palpebrali in platino o oro, plastiche del canto laterale e della palpebra inferiore); solo in casi estremi è giustificata la tarsorrafia temporanea.
L’elettrostimolazione è sconsigliata perchè associata statisticamente ad un aumento delle sincinesie, pur potendo allontanare nel tempo l’atrofia irreversibile della muscolatura mimica se questa è applicata più volte al giorno tutti i giorni. Non è provata l’efficacia dell’ agopuntura o di altre tecniche alternative nell’incrementare il recupero della paralisi di Bell. [McCaul et al. 2014]
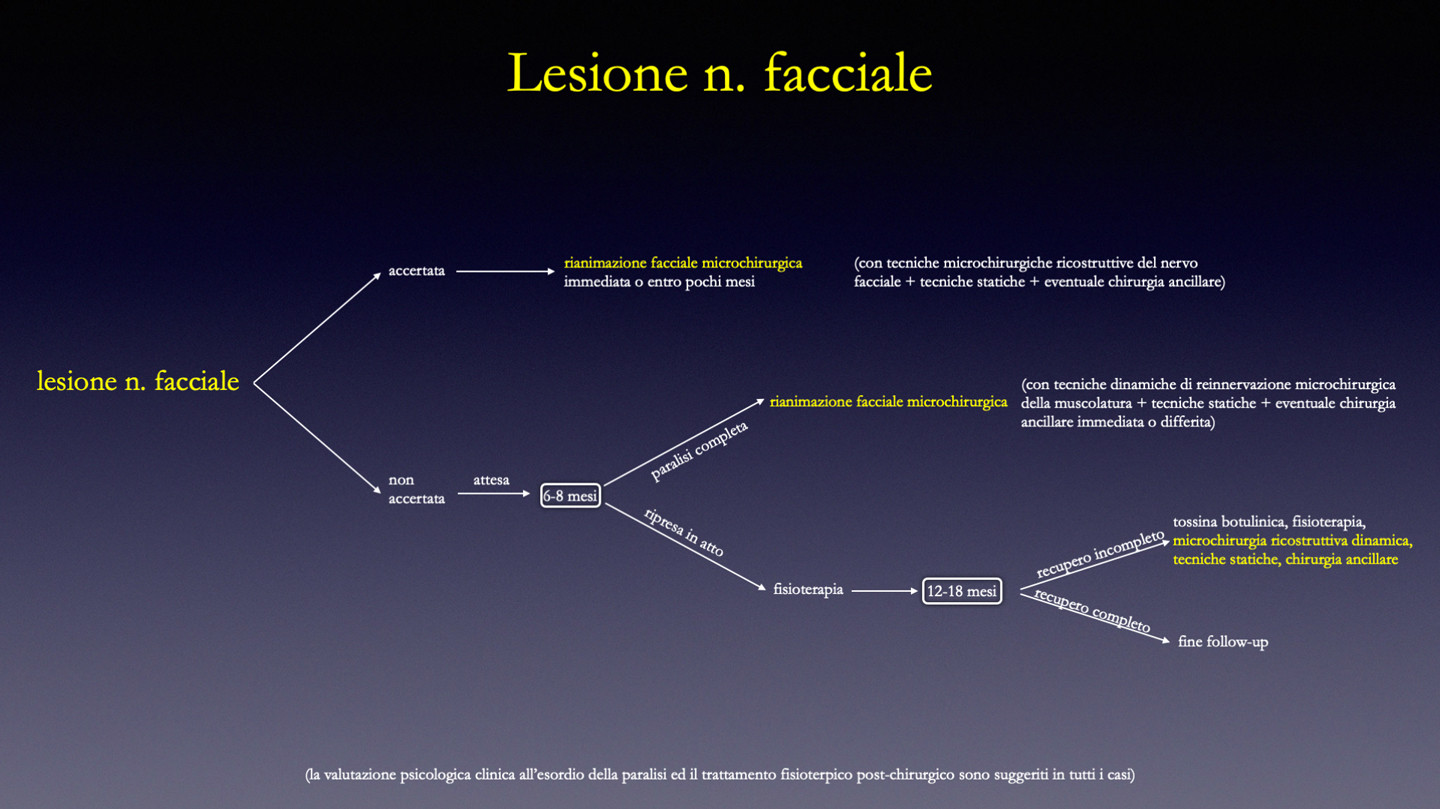
Ricostruzioni immediate: la ricostruzione immediata del nervo facciale è la metodica mi- crochirurgica in assoluto di maggior efficacia. Per questo motivo, in tutti i casi in cui sia effettuabile un ricostruzione immediata, questa deve essere intrapresa. A livello extracranico le lesioni più frequenti del nervo sono dovute a traumi o chirurgia parotidea: in caso di patologia maligna il nervo può essere sacrificato per inglobamento nella neoformazione, in- dissociabilità dal tessuto patologico o evidenza macroscopica di invasione dello stesso da parte del tessuto patologico. In caso di intervento per patologia benigna si può invece verificare la sezione accidentale del nervo facciale o di un suo ramo. La ricostruzione nervosa è più facilmente effettuabile in caso di lesioni extracraniche tramite neurorrafie dirette o con interposizione di innesti nervosi autologhi (n. surale, n. grande auricolare, n. toraco-dorsale. L’utilizzo di nervi di banca è ipoteticamente possibile anche se, a fronte di una morbilità nulla, è attualmente indicato per ricostruzioni di pochi centimetri e non è completamente garantito l’attecchimento dei nervi).
È controversa in letteratura l’influenza negativa che un trattamento radioterapico postoperatorio possa avere sulla reinnervazione motoria. La cosa più probabile è che la radioterapia riduca la vascolarizzazione dei tessuti e rallenti la rigenerazione nervosa, oltre ad incrementare la fibrosi locale con riduzione delle escursioni della muscolatura mimica. Comunque, in assenza di evidenze scientifiche, non appare logico soprassedere ad una ricostruzione del nervo. [Biglioli et al. 2016]
A livello cerebrale ed in base cranica il moncone prossimale del nervo facciale può essere difficilmente anastomizzabile per la sua posizione o anche per la sua struttura poco definita. Va inoltre ricordato che il liquido cefalorachidiano ostacola i processi di guarigione di una neurorrafia. È pertanto lecita una ricostruzione immediata del nervo, in genere tramite un innesto nervoso di interposizione, se in monconi del nervo facciale sono ben definiti. Negli altri casi è invece indicato soprassedere alla ricostruzione per passare immediatamente (o in differita di alcune settimane) ad una delle metodiche normalmente utilizzate per la rianimazione facciale precoce. [Falcioni et al. 2003; Prasad et al. 2018; Sanna et al. 2004; Sanna et al. 2006]
Metodiche addizionali statiche (sospensioni dei tessuti molli, innesti di fascia lata, etc.) e di incremento della competenza palpebrale (tarsorrafia laterale, lipofilling palpebrale, innesto di peso palpebrale, etc.) sono spesso suggerite per migliorare il risultato morfologico e funzionale. Tale chirurgia può essere eseguita primariamente o secondariamente.
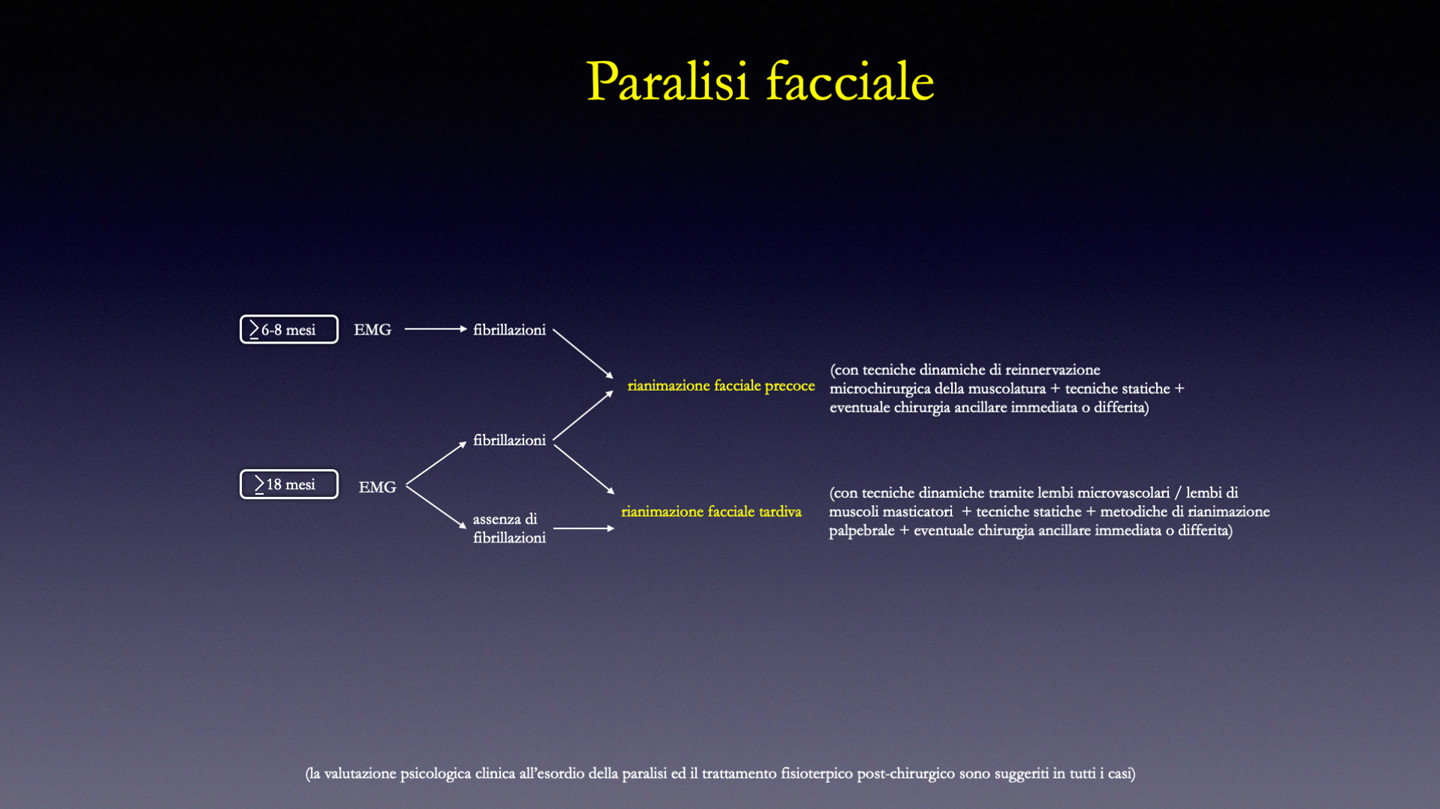
Ricostruzioni precoci: sono quelle applicate a paralisi di relativamente recente insorgenza (in genere non superiore ai 18 mesi) in cui un neurofisiologo dedicato rilevi la presenza di fibrillazioni della muscolatura mimica facciale all’esame elettromiografico, analizzando tutti i singoli distretti cervico-facciali (con particolare riferimento a orbicolare dell’occhio e gruppo zigomatico). Superati i 18 mesi dall’insorgenza della paralisi, pur in presenza di muscolatura mimica fibrillante, ci si espone ad un maggior rischio di insuccesso della neurorrafia e può essere giustificato il passaggio a metodiche ricostruttive tipiche delle paralisi tardive (pur potendosi effettuare comunque un intervento di reinnervazione della muscolatura). In linea di massima, salvo situazioni particolari, non è indicato utilizzare metodiche ricostruttive tipiche delle paralisi tardive (lembo di muscolo temporale, lembi microvascolari, solo presidi statici, etc.) nelle rianimazioni precoci. [Biglioli et al. 2018a]
Se si ha coscienza di un danno irreversibile del nervo facciale (ad esempio sezione o “sfilacciamento” evidente del nervo facciale durante un intervento NCH o ORL) si può procedere immediatamente con la chirurgia ricostruttiva. Nel caso in cui il danno non sia accertato/noto è opportuno attendere 6-8 mesi dall’insorgenza della paralisi prima di intervenire per procedere alla rianimazione facciale. Oltre tale limite di tempo infatti non può avvenire alcuna ripresa funzionale spontanea significativa e il protrarsi dell’attesa non può che favorire una atrofizzazione irreversibile della muscolatura.
Il termine degli 6-8 mesi può essere anticipato in caso di secondo o terzo episodio di para- lisi, in quanto la muscolatura tende a degenerare in modo irreversibile più precocemente. La miscelazione di metodiche statiche e dinamiche è auspicabile per ottimizzare la simmetria a riposo e durante l’attivazione della muscolatura mimica. In ogni caso non è possibile ottenere una restitutio ad integrum morfofunzionale, pur raggiungendo ottimi risultati ricostruttivi con le tecniche oggi a disposizione. Insuccessi di riattivazione dei muscoli mimici e quindi dei movimenti sono da tenere in considerazione e non sono obbligatoriamente imputabili ad errori tecnici. [Biglioli, 2015a]
Il variegato panorama ricostruttivo non permette di indicare una metodica ricostruttiva sulle altre, ma alcuni principi devo essere tenuti in considerazione: la muscolatura mimica viene riattivata attraverso neurorrafie tra il nervo facciale paralitico (o i suoi rami) ed un nervo donatore. Tra i nervi più utilizzati si riassumono le seguenti caratteristiche:
- n. masseterino: ottime capacità di ripristino del movimento, facile utilizzo da parte del paziente, modesta restituzione del tono a riposo della muscolatura (espone a persistenza della ptosi dei tessuti molli). [Bianchi et al. 2014; Biglioli et al. 2015]
- n. ipoglosso: ottime capacità di ripristino del tono a riposo (soluzione della ptosi dei tessuti molli) e difficile utilizzo da parte dei pazienti (solo parzialmente migliorato da fisiote rapia specifica).
- n. facciale controlaterale: sono utilizzabili rami del nervo facciale controlaterale attraver-so l’utilizzo di innesti nervosi (in genere di nervo surale) con metodica cross-face. Questi forniscono in assoluto il miglior stimolo in termini di qualità, ma sono spesso insufficienti per produrre un movimento completo. Le due neurorrafie necessarie per collegare l’in- nesto possono essere effettuate simultaneamente (soluzione più agevole per il paziente ma meno garantita nel risultato) oppure in due tempi separati (scelta più affidabile nei risultati, ma più gravosa per il paziente). Entrambe le scelte sono effettuabili, riservando generalmente il procedimento in due tempi chirurgici ai pazienti più giovani e motivati.
L’utilizzo di più nervi donatori contemporaneamente è possibile e fornisce risultati ottimali. [Biglioli et al. 2018b]
Ricostruzioni tardive: sono considerate paralisi croniche quelle in cui all’esame elettromiografico non siano più riscontrabili fibrillazioni della muscolatura mimica, andata incontro a degenerazione irreversibile fibroadiposa (in genere dopo 18-24 dall’insorgenza della para- lisi). E’ pertanto inutile stimolare una rigenerazione assonale attraverso neurorrafie con nervi donatori (ie n. masseterino, n. ipoglosso, etc.) perchè non arriverebbe al target, ma sostanzialmente alle vestigia muscolari. [Biglioli, 2015b]
Anche in questi casi la miscelazione di rimedi statici e dinamici fornisce i migliori risultati. Quelli statici sono costituiti da innesti di fascia lata, plastiche palpebrali, etc. I dinamici sono rappresentati dall’impiego di lembi microvascolari e lembi di muscoli masticatori. I primi forniscono in linea di massima movimenti più completi e possono più facilmente es- sere innervati anche da rami del nervo facciale controlaterale, con uno stimolo nervoso pertanto più naturale. [Biglioli et al.2011; Biglioli et al. 2012a; Biglioli et al. 2012b; Harii et al. 1998; Manktelow et al. 2006; Vedung et al. 1984]
I lembi di muscoli masticatori (il temporale su tutti) sono invece caratterizzati da una chirurgia meno gravosa, adatta anche a operatori non microchirurghi, ma con velleità di escursioni del sorriso inferiori, pur con ottima correzione statica. Per quanto attiene la competenza palpebrale, tra le metodiche più diffuse sono da considerare il lipofilling e l’inserimento di pesi specifici nella palpebra superiore. Metodiche statiche di correzione del- l’ectropion, sospensione palpebrale, tarsorrafia laterale e altro, sono spesso indicate per completare la competenza palpebrale.
Un capitolo a parte riguarda gli esiti di un recupero incompleto dopo paralisi facciale. Questi sono estremamente frequenti, basti a pensare che riguardano il 30% delle paralisi di Bell. I segni clinici più frequenti sono costituiti da ipotono o ipertono della muscolatura mi- mica a riposo con ptosi o contrattura dei tessuti, sincinesie e paresi, entrambe settoriali o diffuse. Le armi terapeutiche a disposizione sono sostanzialmente tre: fisioterapia, infiltrazioni con tossina botulinica, chirurgia (microchirurgia e chirurgia ancillare). In linea di massima la fisioterapia può condizionare in senso migliorativo i movimenti nelle sincinesie lie- vi. Le infiltrazioni di tossina botulinica hanno efficacia per correggere l’ipertono di base della muscolatura ed alcune sincinesie. [Cecini et al. 2013; Mandrini et al. 2016] La microchirurgia e la chirurgia ancillare hanno indicazione in caso di ritocco di piccoli difetti ma anche nei casi più gravi: i miglioramenti possono essere molto soddisfacenti, ma è pressoché esclusa la restitutio ad integrum. [Biglioli et al. 2017; Biglioli et al. 2018c; Terzis et al. 2009]
Terapia Psicologica
La letteratura suggerisce che la paralisi facciale impatti in modo intenso e significativo sul- lo stato psicologico dei pazienti, che percepiscono una limitazione della qualità di vita (per l’impairment che condiziona l’espressione delle emozioni, il linguaggio, l’identità del Se’) fino a sviluppare risposte disadattive, stati d’ansia e depressione.
Il percorso clinico trattamentale può essere per altro complesso e rendere necessaria una convivenza con un deficit; tale aspetto richiede un processo di adattamento psicoemotivo ad un volto che non si riconosce come proprio, che non riesce ad interagire in modo sod- disfacente, che fatica a sintonizzare espressione ed emozione. L’intervento psicologico clinico si può attivare dunque:
- Nella fase diagnostica, per screenare pazienti che abbiano una componente di distress, di funzionamento ansioso-depressivo, o particolari caratteristiche sul piano della personalità che possano incidere negativamente sull’andamento del trattamento;
- Nella fase peri e post chirurgica per identificare pazienti che presentino risposte di tipo disadattativo (in senso depressivo, o con una percezione amplificata della sintomatologia sollecitata da vissuti angosciosi) per sostenerne la motivazione e ad integrazione delle attività di recupero fisiatriche/fisioterapiche;
- In una fase successiva di monitoraggio, laddove permangano dei deficit, in funzione di un migliore adattamento del paziente a scopo protettivo/preventivo rispetto a eventuali risposte depressive o post-traumatiche.
Fisiatria e fisioterapia
La fisioterapia applicata alla fase di recupero spontaneo della paralisi facciale ha come obbiettivo il favorire i processi di ripresa funzionale del nervo, la coordinazione della funzione della muscolatura mimica e dell’espressività [Biglioli et al. 2012a] all’interno di una dimensione comunicativa. [Prakash et al. 2012]
Attraverso le strategie riabilitative, tenendo conto delle fasi di reinnervazione [Lotter et al. 2012], il paziente è guidato verso un reclutamento qualitativo che mira anche a ridurre significativamente le sincinesie.
Nel caso di rianimazione facciale dopo intervento di reinnervazione con nervi motori differenti dal nervo facciale, questi (il nervo masseterino, l’ipoglosso, i temporali profondi, o lo spinale) dovranno acquisire meccanismi di attivazione propri della nuova funzione che gli viene attribuita tramite la neurorrafia eseguita in sala operatoria (ad esempio il nervo masseterino sarà deputato a stimolare i muscoli zigomatici per sorridere invece che il muscolo massetere per masticare). Gli obiettivi primari sono il recupero del sorriso spontaneo, senza ricorrere alla contrazione volontaria della muscolatura masticatoria e la dissociazione del movimento del sorriso da quello della chiusura dell’occhio.
L’approccio riabilitativo integra vari fattori: esercizi volti al recupero del sorriso e dei movimenti della guancia con l’automatismo di avvicinare i denti, esercizi funzionali, che coordinano i movimenti dell’occhio con quelli della bocca per ottenere la funzione specifica e l’educazione del paziente nell’autogestione degli esercizi al domicilio.
Tenendo presente che ogni azione necessita di un’integrazione multisensoriale e che il cervello concepisce il movimento non in termini di attivazione di singoli muscoli, bensì come insieme di gesti finalizzati [Denlinger et al. 2008], si è visto più efficace proporre esercizi neurocognitivi, per la presa di coscienza del volto e un training funzionale basato sull’evocazione delle emozioni [Konnerth et al. 2016], per stimolare i meccanismi di neuro- plasticità cerebrale. [Previtera et al. 2016]
In termini di tempi di intervento è sconsigliato il trattamento riabilitativo prima di 1 mese dall’insorgenza della paralisi per possibile recupero spontaneo nelle aprassie. A seguire, confermata elettromiograficamente la paralisi, si considera che in linea di massima non sia utile stimolare contrazioni muscolari impossibili che aumentano invece l’attività dal lato sano accentuando l’asimmetria. A tal fine la fisioterapia si concentra sui compensi utili nell’attivita quotidiana (bere, mangiare, come truccarsi, etc.). Sono inoltre utili stimoli tattili e automassaggio di sfioramento (stimolazione afferente trigeminale possibile mediatrice di stimoli al nucleo facciale).
Durante la fase di recupero motorio sono accreditate varie tecniche di stimolazione del movimento associate a presa di coscienza del movimento corretto, ricerca dell’espressività mimica, Bio feedback EMG, o con specchio, o con monitoraggio computerizzato. In tutti i casi è necessario evitare contrazioni massimali e veloci che coinvolgano diffusamente la muscolatura ma suggerire contrazioni analitiche evitando il più possibile le sincinesie. È dimostrato che gli esercizi con “sforzo” tendono a rinforzare le sincinesie . Queste, in parte prevedibili, sono dovute a innervazione collaterale anomala nelle lesioni assonali . Le sincinesie possono comparire coi primi segni di reinnervazione e sono più spesso evidenti dal 4°-5° mese o col progredire della reinnervazione; in questo periodo è fondamentale evitare ogni tipo di contrazione massimale. Il ruolo della tossina botulinica e della microchirurgia nel trattamento delle sincinesie sarà trattato oltre. E’ comunque auspicabile aspettare almeno i 12 dall’insorgenza della paralisi e, possibilmente, una EMG che dimostri non più reinnervazine in atto.
Il trattamento fisioterapico potrà a quel punto essere intersecato con le infiltrazioni con tossina botulinica, atte a inibire movimenti aberranti e facilitare gli esercizi proposti. [Dalla Toffola et al. 2005; Dalla Toffola et al. 2012; Dalla Toffola et al. 2014; Pavese et al. 2013; Pavese et al. 2016; Pavese et al. 2020]
Paralisi facciali congenite
Un capitolo a se è costituito dalle paralisi facciali congenite, patologia rara, che possono presentarsi in forma isolata, o, più spesso, nel contesto di sindromi complesse, in cui la paralisi del VII n.c. rappresenta una delle manifestazioni cliniche della sindrome. Un particolare tipo di paralisi congenita è la sindrome di Moebius, caratterizzata dalla paralisi bilaterale o monolaterale del VII e del VI nervo cranico.
A differenza di quanto avviene nell’adulto, in cui l’eziologia della paralisi è solitamente ben riconducibile ai dati anamnestici o a precedenti trattamenti chirurgici, nel paziente con paralisi congenita il primo e fondamentale step diagnostico è costituito dall’inquadramento diagnostico che impone un approccio multidisciplinare nel quale vengano coinvolti il neonatologo, il genetista, il chirurgo maxillo-facciale, il chirurgo plastico, l’otorinolaringoiatra, l’oculista, il neurologo. In questa fase è importante identificare le eventuali anomalie associate, l’eventuale coinvolgimento di altri nervi cranici ed escludere patologie alternative come quelle di origine muscolare. L’esecuzione di una RM encefalo è ad oggi comunque indicata per escludere problematiche organiche.
Una volta identificata la patologia di base il trattamento della paralisi procede secondo step differenti principalmente in dipendenza dalle varie fasi dello sviluppo del paziente.
In epoca perinatale/neonatale la priorità deve necessariamente essere data alla gestione della disfagia spesso presente in questi pazienti: la valutazione logopedica è quindi fondamentale per garantire un adeguato supporto nutrizionale e prevenire complicanze a livello delle vie aeree. Non meno importante è la valutazione della protezione oculare da parte dell’oculista, anche se il lagoftalmo è generalmente meglio compensato rispetto ai pazienti adulti: raramente sono necessari approcci chirurgici mentre più frequentemente si ricorre a lubrificazione oculare con unguenti e lacrime artificiali. Durante lo sviluppo del paziente sarà fondamentale proseguire la presa in carico logopedica/fisiatrica per osservare l’evoluzione del quadro clinico ed eventualmente intervenire con opportune tecniche riabilitative laddove possibile.
La presa in carico chirurgica dovrebbe generalmente essere considerata a partire dall’età periscolare (5-7 anni) sia per garantire una adeguata osservazione dell’evoluzione clinica che a volte mostra recuperi parziali del movimento, sia per poter intervenire su pazienti maggiormente collaboranti e sviluppati. A partire da quest’età è indicata anche la presa in carico psicologica/neuropsichiatrica per far fronte alle numerose problematiche psico-sociali che affligono generalmente questi pazienti.
Il trattamento chirurgico considerato come gold-standard in questi pazienti è il trapianto di gracile reinnervato. L’utilizzo di altri lembi microvascolari come il latissimus dorsi è comunque possibile in casi selezionati. La scelta del nervo donatore dovrebbe prevedere l’utilizzo del facciale controlaterale mediante metodiche di cross-grafting in due tempi ed il successivo trapianto neuromuscolare. Metodiche di reinnervazione mista mediante nervo masseterino, ipoglosso e spinale possono essere associate in base al quadro clinico. Nelle forme bilaterali la prima scelta è costituita invece dalla reinnervazione mediante nervo masseterino, mentre altri nervi motori come ipoglosso e spinale possono essere usati come alternative in casi particolari.
L’utilizzo di procedure ancillari è indicato per ottimizzare il risultato ottenuto con la chirurgia primaria, anche se generalmente trovano indicazioni più limitate rispetto ai pazienti adulti. Di primaria importanza resta come per i pazienti adulti una adeguata presa in carico riabilitativa post-operatoria. [Bianchi et al. 2020; De Stefani et al. 2019; De Stefani et al. 2021; Nicolini et al. 2019; Terzis et al. 2011; Zuker et al. 2000]
Team paralisi facciali
Anche per i pazienti affetti da paralisi facciale, così come in molte altre patologie, l’orientamento terapeutico moderno è multidisciplinare: chirurgo maxillo-facciale, chirurgo plastico, ORL, neurochirurgo, neurologo/neurofisiologo, oculista, fisiatra, fisioterapista, logopedista, psicologo clinico.
Il paziente viene discusso nei vari aspetti collegialmente e poi, sulla base di quanto emerge, trattato dai singoli specialisti in modo coordinato. Nell’ambito della documentazione necessaria, è fondamentale richiamare l’attenzione sul- la quella fotografica e video, con pose e movimenti standardizzati e seriati nel tempo per poter meglio apprezzare i deficit, i risultati chirurgici, e poter confrontare i dati con quelli raccolti presso altri centri. Tra le classificazioni chirurgiche più utili in tal senso si sottolinea la e-face scale proposta dalla Bell’s Society.

Società Italiana di Chirurgia Maxillo-Facciale – SICMF ha deciso di elaborare le Raccomandazioni di buona pratica clinica per le lesione nervose del cavo orale
